BATERIAS Y ACUMULADORES
El fundamento de los acumuladores es la transformación de la energía química en eléctrica.
Almacenan energía química en su interior para convertirla en eléctrica en el exterior.
Los acumuladores eléctricos mantienen una d.d.p o tensión entre sus dos polos gracias a un proceso químico que sucede en su interior y que luego explicaremos.
Esta d.d.p. hace que al conectar un receptor (lámpara, motor, timbre, etc.) entre los dos polos, circule una corriente eléctrica de un polo al otro (del negativo al positivo).
Por el receptor pasará esta corriente y se pondrá en funcionamiento.
Los acumuladores eléctricos pueden ser pilas o baterias.
Luego veremos la diferencia.
Fíjate en la imagen:
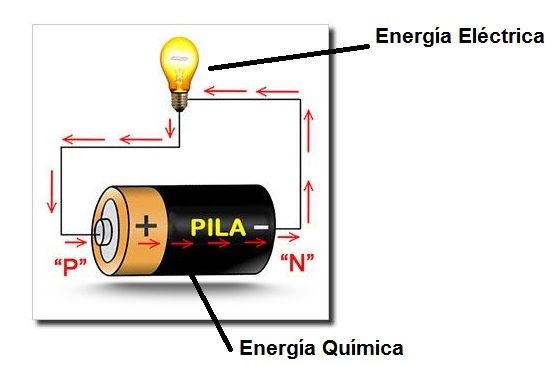
La base para un funcionamiento de un acumulador es el intercambio de electrones entre dos reacciones químicas, una reacción de oxidación y una reacción de reducción que inicialmente están separadas.
Al unirlas por un circuito eléctrico externo se produce el intercambio (paso) de electrones de la reacción de oxidación a la reacción de reducción, a través del circuito eléctrico exterior.
Luego lo veremos con más detalle.
Los acumuladores (pilas y/o baterias) pueden ser recargables, lo que significa que cuando se descargan eléctricamente, es decir su tensión o d.d.p es igual a 0 en su polos, si las sometemos a una corriente eléctrica externa (conectamos la bateria a una corriente) la bateria se carga de nuevo.
Ahora veamos como se produce el fenómeno de la electroquimica en el interior de una bateria.
Veremos las baterías electroquímicas, si te interesan las mas modernas de litio te recomendamos el siguiente enlace: Baterias de Litio.
Una celda, o vaso, es una caja en cuyo interior hay un líquido llamado electrolito (Pueden ser 2 líquidos, pero si son 2 están separados).
El líquido tiene sumergido en su interior dos placas metálica diferente, llamadas electrodos.
Estos electrodos antes de introducirlos en el líquido no tienen carga eléctrica.
Cada celda proporciona entre 1,5V y 2V de tensión, como luego veremos, por eso para formar una bateria se unen en serie varias celdas y se suman las tensiones (bateria de celdas = bateria)
Dependiendo del material de los electrodos y de líquido del electrolito tenemos diferentes tipos de baterias.
Por ejemplo, las baterías de plomo que se utilizan para el arranque de coches y motos, tienen un electrodo de plomo puro, el otro electrodo es de dióxido de plomo y el electrolito es ácido sulfúrico disuelto en agua.
Producción de Electricidad en una Celda
Uno de los electrodos debe ser de un metal que al ponerse en contacto con el electrolito se oxide y por esta reacción de oxidación se desprendan y pasen al líquido o electrolito iones +, quedando entonces la placa con carga -, o lo que es lo mismo con exceso de electrones.
Si inicialmente el material su carga es 0, al desprenderse iones + queda con carga - y la carga negativa es la de los electrones.
Este electrodo será el polo negativo o cátodo.
En el otro electrodo al introducirlo en su electrolito se produce una reacción de reducción, reacción que produce que el electrodo se desprenda de electrones que pasan al líquido o electrolito.
Al soltar electrones el electrodo quedará con carga +, por eso este otro electrodo será el polo + o cátodo.
Reacción de Oxidación: la placa metálica pierde iones + y se queda con electrones (carga negativa).
Se produce en el ánodo, lado negativo.
Reacción de Reducción: La placa metálica pierde electrones que pasan al líquido y se queda con iones + (carga positiva).
Se produce en el cátodo, lado positivo.
Entre los 2 electrodos se produce una diferencia de potencia (d.d.p) o tensión. Uno tiene potencial -, el ánodo, y el otro potencial positivo, el cátodo.
Al unir los electrodo mediante un circuito eléctrico externo (una bombilla por ejemplo), como hay una d.d.p entre los 2 electrodos se producirá una corriente eléctrico.
Es decir los electrones sobrantes del cátodo pasarán al ánodo por el circuito produciéndose una corriente eléctrica.
Una vez toda la carga negativa pasa al otro lado dejará de pasar corriente y la batería estará descargada.
Si es recargable podremos cargarla con el proceso inverso, metiendo corriente por los dos polos.
Veamos esto en una animacion de video con un ejemplo.
El ejemplo del video es una celda con 2 líquidos (electrodos) diferentes, por lo que tiene 2 semiceldas.
Como ves hay un puente entre los dos líquidos para que se produzca por el el paso de los electrones (corriente eléctrica).
Las reacciones que se producen no se producen de forma eterna, por eso al cabo de un tiempo la batería se descarga por completo.

Explicación del fenómeno de la electroquímica
El vaso de la izquierda contiene una solución o líquido de sulfato de zinc, en este líquido se introduce una barra de zinc y los átomos de esta barra se oxidan y pasan a la solución en forma de iones positivos, mientras que la barra o electrodo queda cargado negativamente, es decir, con un exceso de electrones.
Estos electrones pasan a través del conductor hasta la otra barra, que es de cobre, y está sumergida en el vaso de la derecha en una solución de sulfato de cobre.
Allí los iones de cobre de la sal se reducen al tomar los electrones de la barra y se depositan en el fondo en forma de metal.
El electrodo donde se lleva a cabo la oxidación recibe el nombre de ánodo o polo -, y el electrodo donde se lleva a cabo la reducción recibe el nombre de cátodo o polo +.
Al unir los dos polos mediante un circuito eléctrico, se produce un paso de electrones (corriente eléctrica) desde el polo negativo al positivo.
Este proceso se llama electrolisis.
Como ves la energía química de los líquidos y placas se transforma en electricidad en el exterior.
Cuando los polos de la celda no están unidos por un circuito externo, entre los dos polos hay una tensión o diferencia de potencial (d.d.p) química.
Esta tensión es la que hace que al unirlos se produzca la corriente eléctrica.
Cualquier elemento que haga esto es un acumulador eléctrico, ya que acumula energía en su interior para usarla cuando sea conveniente (cuando se unan los polos).
Las pilas y las baterías son acumuladores.
Tanto las pilas y las baterías son acumuladores, pero... ¿Cual es la diferencia entre Pila y Batería?
Pila = solo tiene una celda.
Batería = Formada por varias celdas unidas en serie (una bateria de celdas electroquímicas).
Cuando unimos varias celdas en serie, uniendo polo + de la primera celda con el - de la segunda y así sucesivamente, obtenemos una batería.
Con esto conseguimos un acumulador o batería que tiene más tensión o voltaje que una sola celda.
Por ejemplo, una batería de auto de 12V es un conjunto en serie de 6 celdas de plomo-ácido de 2V cada una.

Se llama batería porque las celdas se colocan juntas una detrás de otra, en batería, como si fuera una batería de celdas.
Una batería puede ser ácida o alcalina en función de la naturaleza del electrolito (líquido en su interior).
Por ejemplo, las baterías de los coches son ácidas, porque contienen un electrolito de ácido sulfúrico en el que se sumergen una placa de plomo metálico y otra de dióxido de plomo.
Cuando se agota el plomo o el dióxido de plomo la batería está gastada y para recargarla se hace pasar una corriente eléctrica de la placa positiva a la negativa mediante un alternador o dinamo (o a veces conectándola al enchufe de casa), de manera que el sulfato de plomo se vuelve a descomponer en plomo en la placa negativa, y en la positiva en dióxido de plomo.
Las pilas secundarias son aquellas que pueden recargarse, es decir pueden reiniciar el proceso mediante el aporte de energía de una fuente exterior normalmente un generador, que hace que los compuestos químicos se transformen en los compuestos de partida al hacer pasar corriente a través de ellos en sentido opuesto.
¿Quién fue el inventor de la batería? Pues fue el señor Alessandri Volta, físico italiano, y el Voltio unidad de tensión o d.d.p.es en honor a él.
Algunas veces, la pila es un término que se suele usar cuando hablamos de generadores de electricidad basados en procesos químicos normalmente no reversibles, o acumuladores de energía eléctrica no recargables (aunque hoy en día las hay recargables), mientras que batería se aplica generalmente a los dispositivos electroquímicos semi-reversibles, o acumuladores de energía eléctrica que sí se pueden recarga.
Tanto pila como batería son términos provenientes de los primeros tiempos de la electricidad, en los que se juntaban varios elementos o celdas: en el primer, caso uno encima de otro, "apilados", y en el segundo, adosados lateralmente, "en batería", como se sigue haciendo actualmente, para aumentar así la magnitud de los fenómenos eléctricos y poder estudiarlos sistemáticamente.

Si te ha gustado haz click en Compartir, Gracias:
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
Almacenan energía química en su interior para convertirla en eléctrica en el exterior.
Los acumuladores eléctricos mantienen una d.d.p o tensión entre sus dos polos gracias a un proceso químico que sucede en su interior y que luego explicaremos.
Esta d.d.p. hace que al conectar un receptor (lámpara, motor, timbre, etc.) entre los dos polos, circule una corriente eléctrica de un polo al otro (del negativo al positivo).
Por el receptor pasará esta corriente y se pondrá en funcionamiento.
Los acumuladores eléctricos pueden ser pilas o baterias.
Luego veremos la diferencia.
Fíjate en la imagen:

La base para un funcionamiento de un acumulador es el intercambio de electrones entre dos reacciones químicas, una reacción de oxidación y una reacción de reducción que inicialmente están separadas.
Al unirlas por un circuito eléctrico externo se produce el intercambio (paso) de electrones de la reacción de oxidación a la reacción de reducción, a través del circuito eléctrico exterior.
Luego lo veremos con más detalle.
Los acumuladores (pilas y/o baterias) pueden ser recargables, lo que significa que cuando se descargan eléctricamente, es decir su tensión o d.d.p es igual a 0 en su polos, si las sometemos a una corriente eléctrica externa (conectamos la bateria a una corriente) la bateria se carga de nuevo.
Ahora veamos como se produce el fenómeno de la electroquimica en el interior de una bateria.
Veremos las baterías electroquímicas, si te interesan las mas modernas de litio te recomendamos el siguiente enlace: Baterias de Litio.
Celdas ElectroQuímicas
El acumulador más sencillo es lo que se llama una celda electroquímica, también llamada celda Voltaica.Una celda, o vaso, es una caja en cuyo interior hay un líquido llamado electrolito (Pueden ser 2 líquidos, pero si son 2 están separados).
El líquido tiene sumergido en su interior dos placas metálica diferente, llamadas electrodos.
Estos electrodos antes de introducirlos en el líquido no tienen carga eléctrica.
Cada celda proporciona entre 1,5V y 2V de tensión, como luego veremos, por eso para formar una bateria se unen en serie varias celdas y se suman las tensiones (bateria de celdas = bateria)
Dependiendo del material de los electrodos y de líquido del electrolito tenemos diferentes tipos de baterias.
Por ejemplo, las baterías de plomo que se utilizan para el arranque de coches y motos, tienen un electrodo de plomo puro, el otro electrodo es de dióxido de plomo y el electrolito es ácido sulfúrico disuelto en agua.
Producción de Electricidad en una Celda
Uno de los electrodos debe ser de un metal que al ponerse en contacto con el electrolito se oxide y por esta reacción de oxidación se desprendan y pasen al líquido o electrolito iones +, quedando entonces la placa con carga -, o lo que es lo mismo con exceso de electrones.
Si inicialmente el material su carga es 0, al desprenderse iones + queda con carga - y la carga negativa es la de los electrones.
Este electrodo será el polo negativo o cátodo.
En el otro electrodo al introducirlo en su electrolito se produce una reacción de reducción, reacción que produce que el electrodo se desprenda de electrones que pasan al líquido o electrolito.
Al soltar electrones el electrodo quedará con carga +, por eso este otro electrodo será el polo + o cátodo.
Reacción de Oxidación: la placa metálica pierde iones + y se queda con electrones (carga negativa).
Se produce en el ánodo, lado negativo.
Reacción de Reducción: La placa metálica pierde electrones que pasan al líquido y se queda con iones + (carga positiva).
Se produce en el cátodo, lado positivo.
Entre los 2 electrodos se produce una diferencia de potencia (d.d.p) o tensión. Uno tiene potencial -, el ánodo, y el otro potencial positivo, el cátodo.
Al unir los electrodo mediante un circuito eléctrico externo (una bombilla por ejemplo), como hay una d.d.p entre los 2 electrodos se producirá una corriente eléctrico.
Es decir los electrones sobrantes del cátodo pasarán al ánodo por el circuito produciéndose una corriente eléctrica.
Una vez toda la carga negativa pasa al otro lado dejará de pasar corriente y la batería estará descargada.
Si es recargable podremos cargarla con el proceso inverso, metiendo corriente por los dos polos.
Veamos esto en una animacion de video con un ejemplo.
El ejemplo del video es una celda con 2 líquidos (electrodos) diferentes, por lo que tiene 2 semiceldas.
Como ves hay un puente entre los dos líquidos para que se produzca por el el paso de los electrones (corriente eléctrica).
Las reacciones que se producen no se producen de forma eterna, por eso al cabo de un tiempo la batería se descarga por completo.

Explicación del fenómeno de la electroquímica
El vaso de la izquierda contiene una solución o líquido de sulfato de zinc, en este líquido se introduce una barra de zinc y los átomos de esta barra se oxidan y pasan a la solución en forma de iones positivos, mientras que la barra o electrodo queda cargado negativamente, es decir, con un exceso de electrones.
Estos electrones pasan a través del conductor hasta la otra barra, que es de cobre, y está sumergida en el vaso de la derecha en una solución de sulfato de cobre.
Allí los iones de cobre de la sal se reducen al tomar los electrones de la barra y se depositan en el fondo en forma de metal.
El electrodo donde se lleva a cabo la oxidación recibe el nombre de ánodo o polo -, y el electrodo donde se lleva a cabo la reducción recibe el nombre de cátodo o polo +.
Al unir los dos polos mediante un circuito eléctrico, se produce un paso de electrones (corriente eléctrica) desde el polo negativo al positivo.
Este proceso se llama electrolisis.
Como ves la energía química de los líquidos y placas se transforma en electricidad en el exterior.
Cuando los polos de la celda no están unidos por un circuito externo, entre los dos polos hay una tensión o diferencia de potencial (d.d.p) química.
Esta tensión es la que hace que al unirlos se produzca la corriente eléctrica.
Cualquier elemento que haga esto es un acumulador eléctrico, ya que acumula energía en su interior para usarla cuando sea conveniente (cuando se unan los polos).
Las pilas y las baterías son acumuladores.
Tanto las pilas y las baterías son acumuladores, pero... ¿Cual es la diferencia entre Pila y Batería?
Pila = solo tiene una celda.
Batería = Formada por varias celdas unidas en serie (una bateria de celdas electroquímicas).
Baterías
Una batería está formada por varias celdas o vasos, cada una de estas celdas es un acumulador o pila por si misma.Cuando unimos varias celdas en serie, uniendo polo + de la primera celda con el - de la segunda y así sucesivamente, obtenemos una batería.
Con esto conseguimos un acumulador o batería que tiene más tensión o voltaje que una sola celda.
Por ejemplo, una batería de auto de 12V es un conjunto en serie de 6 celdas de plomo-ácido de 2V cada una.

Se llama batería porque las celdas se colocan juntas una detrás de otra, en batería, como si fuera una batería de celdas.
Una batería puede ser ácida o alcalina en función de la naturaleza del electrolito (líquido en su interior).
Por ejemplo, las baterías de los coches son ácidas, porque contienen un electrolito de ácido sulfúrico en el que se sumergen una placa de plomo metálico y otra de dióxido de plomo.
Cuando se agota el plomo o el dióxido de plomo la batería está gastada y para recargarla se hace pasar una corriente eléctrica de la placa positiva a la negativa mediante un alternador o dinamo (o a veces conectándola al enchufe de casa), de manera que el sulfato de plomo se vuelve a descomponer en plomo en la placa negativa, y en la positiva en dióxido de plomo.
Las pilas secundarias son aquellas que pueden recargarse, es decir pueden reiniciar el proceso mediante el aporte de energía de una fuente exterior normalmente un generador, que hace que los compuestos químicos se transformen en los compuestos de partida al hacer pasar corriente a través de ellos en sentido opuesto.
¿Quién fue el inventor de la batería? Pues fue el señor Alessandri Volta, físico italiano, y el Voltio unidad de tensión o d.d.p.es en honor a él.
Algunas veces, la pila es un término que se suele usar cuando hablamos de generadores de electricidad basados en procesos químicos normalmente no reversibles, o acumuladores de energía eléctrica no recargables (aunque hoy en día las hay recargables), mientras que batería se aplica generalmente a los dispositivos electroquímicos semi-reversibles, o acumuladores de energía eléctrica que sí se pueden recarga.
Tanto pila como batería son términos provenientes de los primeros tiempos de la electricidad, en los que se juntaban varios elementos o celdas: en el primer, caso uno encima de otro, "apilados", y en el segundo, adosados lateralmente, "en batería", como se sigue haciendo actualmente, para aumentar así la magnitud de los fenómenos eléctricos y poder estudiarlos sistemáticamente.

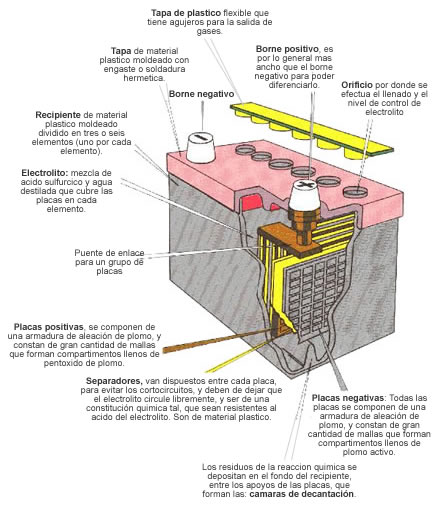
Partes de una Batería
Aquí os dejamos un esquema de una batería con todas sus partes:
Si te ha gustado haz click en Compartir, Gracias:
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
TAMBIEN TE PUEDE INTERESAR
Baterias Para Paneles Solares
Magnitudes Eléctricas
Energia Potencial Electrica
Qué Hacer con las Pilas Usadas
Crear una Pila con Limones
Corriente Continua y Alterna
Efecto Fotoelectrico
El Motor Eléctrico
Cosas Tecnologicas
Circuitos Electricos
